Ikatan Kimia I: Konsep Dasar
Tujuan
2. Mampu menjelaskan konsep dasar ikatan kimia
alat dan bahan
Alat
Bahan
Gas Sensor (MQ2) adalah sensor yang berguna untuk mendeteksi kebocoran gas baik pada rumah maupun industri. Sensor ini sangat cocok untuk mendeteksi H2, LPG, CH4, CO, Alkohol, Asap atau Propane. Karena sensitivitasnya yang tinggi dan waktu respon yang cepat, pengukuran dapat dilakukan dengan cepat.
Dasar Teori
A. Simbol Titik Lewis
Pengembangan tabel periodik dan konsep konfigurasi elektron memberi ahli kimia alasan untuk pembentukan molekul dan senyawa. Penjelasan ini, yang diformulasikan oleh Gilbert Lewis, adalah bahwa atom bergabung untuk mencapai konfigurasi elektron yang lebih stabil. Stabilitas maksimum terjadi ketika atom isoelektron dengan gas mulia.
Ketika atom berinteraksi membentuk ikatan kimia, hanya bagian luarnya yang bersentuhan. Karena alasan ini, ketika kita mempelajari ikatan kimia, kita terutama memperhatikan elektron valensi atom.ahli kimia menggunakan sistem titik yang dirancang oleh Lewis yang disebut simbol titik Lewis. Simbol titik Lewis terdiri dari simbol unsur dan satu titik untuk setiap elektron valensi dalam atom unsur. Unsur dalam golongan yang sama memiliki konfigurasi elektron terluar yang serupa dan karenanya simbol titik Lewis juga serupa.
B. Ikatan ionik
atom unsur dengan energi ionisasi rendah cenderung membentuk kation, sedangkan atom unsur dengan afinitas elektron tinggi cenderung membentuk anion. Sebagai aturan, unsur yang paling mungkin membentuk kation dalam senyawa ion adalah logam alkali dan logam alkali tanah, dan unsur yang paling mungkin membentuk anion adalah unsur golongan halogen dan oksigen.
Ikatan ion adalah gaya elektrostatik yang menyatukan ion dalam senyawa ionik.misalnya, reaksi antara litium dan fluor membentuk litium fluorida,Konfigurasi elektron litium adalah 1s²2s¹, dan fluorin adalah 1s²2s²2p⁵. Ketika atom litium dan florin bersentuhan satu sama lain, elektron valensi 2s¹ dari lithium ditransfer ke atom florin. Dengan menggunakan simbol titik Lewis, kita merepresentasikan reaksi seperti ini:
(9.1)
Untuk kenyamanan, bayangkan reaksi ini terjadi dalam langkah terpisah — pertama ionisasi Li:
dan kemudian penerimaan elektron oleh F:
Selanjutnya, bayangkan dua ion terpisah bergabung membentuk satuan senyawa LiF:
Ikatan ionik dalam LiF adalah tarikan elektrostatik antara ion litium bermuatan positif dan ion florida bermuatan negatif. Senyawa itu sendiri netral secara muatan listrik.
C. Energi Kisi Senyawa Ionik
Energi kisi tidak dapat diukur secara langsung. Namun, jika kita mengetahui struktur dan komposisi senyawa ionik, kita dapat menghitung energi kisi senyawa dengan menggunakan hukum Coulomb, yang menyatakan bahwa energi potensial (E) antara dua ion berbanding lurus dengan produk muatannya dan berbanding terbalik dengan jarak pemisahan di antara keduanya.
Kita juga dapat menentukan energi kisi secara tidak langsung, dengan mengasumsikan bahwa pembentukan senyawa ionik terjadi dalam serangkaian langkah-langkah. Prosedur ini, yang dikenal sebagai siklus Born-Haber, menghubungkan energi kisi senyawa ionik dengan energi ionisasi, afinitas elektron, dan sifat-sifat atom dan molekul lainnya.
Berikut adalah contoh Siklus Born-Haber:
Siklus Born-Haber untuk pembentukan 1 mol LiF padat.
Tabel energi kisi dan titik lebur senyawa
D. Ikatan Kovalen
Jenis pasangan elektron ini adalah contoh dari ikatan kovalen, yaitu ikatan yang terbentuk dari dua elektron yang dipakai bersama oleh kedua atom H. Senyawa kovalen adalah senyawa yang hanya mengandung ikatan kovalen.Dalam ikatan kovalen, setiap elektron dalam pasangan yang dipakai bersama tertarik ke inti kedua atom. Daya tarik ini menyatukan kedua atom dalam H₂ dan daya tarik ini berperan dalam pembentukan ikatan kovalen pada molekul lain.
Atom dapat membentuk berbagai jenis ikatan kovalen. Dalam satu ikatan, dua atom disatukan oleh satu pasangan elektron. Banyak senyawa disatukan oleh ikatan rangkap, Ikatan rangkap ada dua yaitu ikatan rangkap dua dan rangkap tiga.
Panjang ikatan didefinisikan sebagai jarak antara inti kedua atom yang terikat secara kovalen dalam suatu molekul
Perbandingan Sifat-sifat Senyawa Kovalen dan Ionik
Sebagian besar senyawa kovalen tidak larut dalam air, atau jika larut, larutan encernya umumnya tidak menghantarkan listrik, karena senyawanya nonelektrolit. Larutan senyawa ionik menghantarkan listrik karena mengandung kation dan anion yang dapat bergerak; senyawa kovalen cair atau molten tidak menghantarkan listrik karena tidak ada ion.
E. Elektronegatifitas
Keelektronegatifan adalah konsep relatif, yang berarti bahwa keelektronegatifan suatu unsur hanya dapat diukur dalam kaitannya dengan keelektronegatifan unsur lain. Linus Pauling menemukan metode untuk menghitung elektronegatifitas relatif dari sebagian besar unsur. Nilai-nilai ini ditunjukkan pada Gambar 9.5.
Keelektronegatifan adalah konsep relatif, yang berarti bahwa keelektronegatifan suatu unsur hanya dapat diukur dalam kaitannya dengan keelektronegatifan unsur lain. Linus Pauling menemukan metode untuk menghitung elektronegatifitas relatif dari sebagian besar unsur. Nilai-nilai ini ditunjukkan pada Gambar 9.5.
Keelektronegatifan dan Bilangan Oksidasi
Konsep elektronegatifitas adalah dasar untuk aturan-aturan ini. Pada intinya, bilangan oksidasi mengacu pada jumlah
muatan yang dimiliki sebuah atom jika elektron ditransfer sepenuhnya ke atom elektronegatif yang terikat dalam suatu molekul.
Percobaan
Prosedur Percobaan
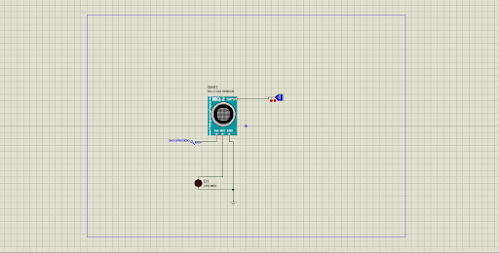
- Untuk membuat rangkaian sensor tegangan. Pertama, siapkan alat dan bahan yang bersangkutan, di ambil dari library proteus
- Letakkan semua alat dan bahan sesuai dengan posisi dimana alat dan bahan terletak.
- Tepatkan posisi letak nya dengan gambar rangkaian
- Selanjutnya, hubungkan semua alat dan bahan menjadi suatu rangkaian yang utuh
- Lalu mencoba menjalankan rangkaian , jika tidak terjadi error, maka Rangkaian sudah berjalan
Rangkaian
Ketika terjadi proses pemanasan, kumparan akan dipanaskan sehingga SnO2 keramik menjadi semikonduktor atau sebagai penghantar sehingga melepaskan elektron dan ketika asap dideteksi oleh sensor dan mencapai aurum elektroda maka output sensor MQ-2 akan menghasilkan tegangan analog.
.
Sensor MQ-2 ini memiliki 6 buah masukan yang terdiri dari tiga buah power supply (Vcc) sebasar +5 volt untuk mengaktifkan heater dan sensor, Vss (Ground), dan pin keluaran dari sensor tersebut.





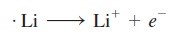











Tidak ada komentar:
Posting Komentar